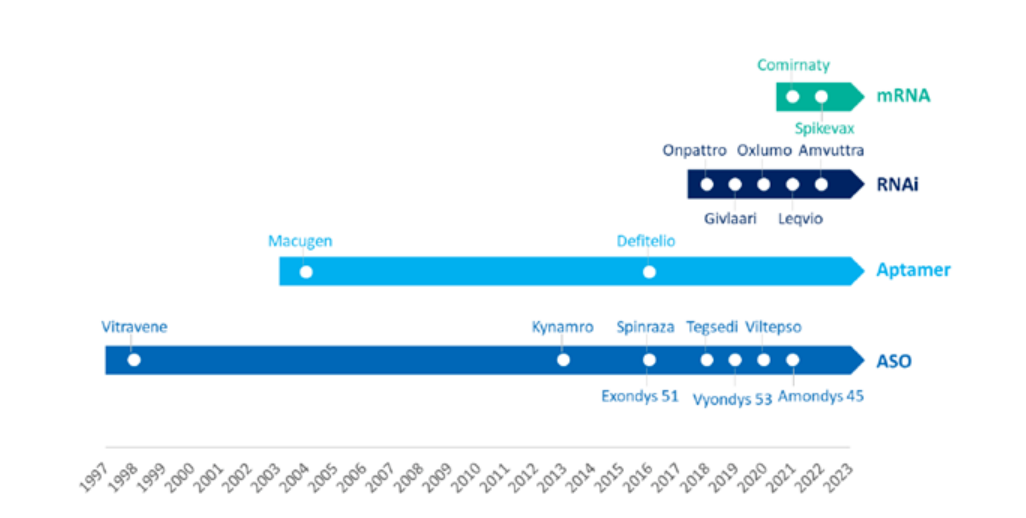
מקור: WuXi AppTec
בשנים האחרונות, תחום הטיפול ב-RNA הראה מגמה נפיצה-רק ב-5 השנים האחרונות, 11 טיפולי RNA אושרו על ידי ה-FDA, ומספר זה אפילו עולה על סך טיפולי ה-RNA שאושרו בעבר!בהשוואה לטיפולים מסורתיים, טיפול ב-RNA יכול לפתח במהירות טיפולים ממוקדים עם אחוזי הצלחה גבוהים יותר כל עוד רצף הגנים של המטרה ידוע.מצד שני, רוב טיפולי ה-RNA עדיין זמינים רק לטיפול במחלות נדירות, ופיתוחם של טיפולים כאלה עדיין עומדת בפני אתגרים מרובים במונחים של עמידות הטיפול, הבטיחות והאספקה.במאמר של היום, הצוות התוכן של WuXi AppTec יסקור את ההתקדמות בתחום הטיפול ב-RNA בשנה האחרונה, ויצפה לעתיד של תחום מתפתח זה עם הקוראים.
▲ 11 טיפולי RNA או חיסונים אושרו על ידי ה-FDA ב-5 השנים האחרונות
ממחלות נדירות ועד למחלות נפוצות, פורחים יותר פרחים
במגיפת הכתר החדשה, חיסון ה-mRNA נולד משום מקום וזכה לתשומת לב נרחבת מהתעשייה.לאחרפריצת דרך בפיתוח חיסונים למחלות זיהומיות, אתגר מרכזי נוסף העומד בפני טכנולוגיית mRNA הוא הרחבת היקף היישום לטיפול ומניעה של מחלות נוספות.
ביניהם,חיסונים מותאמים אישית לסרטן הם תחום יישום חשוב של טכנולוגיית mRNA, וראינו גם תוצאות קליניות חיוביות של מספר חיסונים לסרטן השנה.רק החודש, חיסון הסרטן האינדיבידואלי שפותח במשותף על ידי Moderna ו-Merk, בשילוב עם מעכב PD-1 Keytruda,הפחית את הסיכוןשל הישנות או מוות בחולים עם מלנומה בשלב III ו-IV לאחר כריתה מלאה של הגידול ב-44% (לעומת מונותרפיה של Keytruda).בהודעה לעיתונות צוין כי זו הפעם הראשונה שחיסון סרטן mRNA מראה יעילות בטיפול במלנומה בניסוי קליני אקראי, המהווה אירוע ציון דרך בפיתוח חיסוני סרטן mRNA.
בנוסף, חיסוני mRNA יכולים גם לשפר את ההשפעה הטיפולית של טיפול בתאים.לדוגמה, מחקר של BioNTech הצביע על כך שאם חולים מקבלים עירוי לראשונה עם מינון נמוך של טיפול CAR-T ממוקד CLDN6BNT211, ולאחר מכן מוזרק עם חיסון mRNA המקודד ל-CLDN6, הם יכולים לעורר תאי CAR-T in vivo על ידי ביטוי CLDN6 על פני השטח של תאים המציגים אנטיגן.הגברה, ובכך משפרת את האפקט האנטי סרטני.תוצאות ראשוניות הראו כי 4 מתוך 5 מטופלים שקיבלו את הטיפול המשולב השיגו תגובה חלקית, או 80%.
בנוסף לטיפול ב-mRNA, טיפול באוליגונוקלאוטידים וטיפול ב-RNAi השיגו גם תוצאות טובות בהרחבת היקף המחלות.בטיפול בהפטיטיס B כרונית, כמעט 30% מהחולים אינם יכולים לזהות אנטיגן משטח הפטיטיס B ו-DNA של נגיף הפטיטיס B in vivo לאחר שימוש בטיפול ב-antisense oligonucleotide.bepirovirsen שפותחה במשותף על ידי GSK ו-Ionisלמשך 24 שבועות.בחלק מהחולים, אפילו 24 שבועות לאחר הפסקת הטיפול, עדיין לא ניתן היה לזהות את הסמנים הללו של הפטיטיס B בגוף.
במקרה, הטיפול ב-RNAiVIR-2218 שפותח במשותף על ידי Vir Biotechnology ואלנילם שולבעם אינטרפרון α, ובניסויים קליניים שלב 2, כ-30% מחולי הפטיטיס B כרוניים גם לא הצליחו לזהות אנטיגן משטח הפטיטיס B (HBsAg).בנוסף, חולים אלה פיתחו נוגדנים נגד חלבון הפטיטיס B, שהראו תגובה חיובית של מערכת החיסון.אם לוקחים את התוצאות הללו ביחד, התעשייה מציינת שטיפול ב-RNA עשוי להיות המפתח לריפוי פונקציונלי להפטיטיס B.
זו יכולה להיות רק ההתחלה של טיפול ב-RNA למחלות נפוצות.לפי צנרת המו"פ של אלנילם, היא מפתחת גם טיפולי RNAi לטיפול ביתר לחץ דם, מחלת אלצהיימר וסטאטהפטיטיס לא אלכוהולית, וכדאי לצפות לו לעתיד.
פריצת צוואר הבקבוק של מתן טיפול ב-RNA
מתן טיפול ב-RNA הוא אחד מצווארי הבקבוק המגבילים את היישום שלו.מדענים מפתחים גם מגוון טכנולוגיות למתן טיפול ספציפי ב-RNA לאיברים ורקמות מלבד הכבד.
אחת השיטות הפוטנציאליות היא "לקשור" RNA טיפולי עם מולקולות ספציפיות לרקמות.לדוגמה, Avidity Biosciences הודיעה לאחרונה כי הפלטפורמה הטכנולוגית שלה יכולה לקשר נוגדנים חד שבטיים לאוליגונוקלאוטידיםקושרים ביעילות siRNAs.נשלח לשריר השלד.בהודעה לעיתונות צוין כי זו הפעם הראשונה שניתן למקד בהצלחה את siRNA ולהעביר אותה לרקמת השריר האנושית, המהווה פריצת דרך גדולה בתחום הטיפול ב-RNA.
מקור תמונה: 123RF
בנוסף לטכנולוגיית צימוד נוגדנים, מספר חברות המפתחות ננו-חלקיקי שומנים (LNP) "משדרגות" גם נשאים כאלה.לדוגמה, ReCode Therapeuticמשתמשת בטכנולוגיית LNP (SORT) הייחודית להתמקדות באיברים סלקטיביים כדי לספק מגוון סוגים שונים של טיפול ב-RNA לריאות, לטחול, לכבד ולאיברים אחרים.השנה הודיעה החברה על השלמת סבב גיוס של 200 מיליון דולר מסדרה B, כאשר בהשקעה ישתתפו מחלקות ההון סיכון של פייזר, באייר, אמגן, סאנופי וחברות תרופות גדולות אחרות.Kernal Biologics, שגם קיבלה השנה מימון של 25 מיליון דולר מסדרה A, מפתחת גם LNPs שאינם מצטברים בכבד, אך יכולים לספק mRNA לתאי מטרה כגון המוח או גידולים ספציפיים.
Orbital Therapeutics, שעלה לראשונה השנה, לוקחת גם את אספקת הטיפול ב-RNA ככיוון מפתח להתפתחות.על ידי שילוב טכנולוגיית RNA ומנגנוני אספקה, החברה מצפה לבנות פלטפורמת טכנולוגית RNA ייחודית שיכולה להאריך את ההתמדה ואת מחצית החיים של תרופות RNA חדשניות ולהעביר אותם למגוון סוגי תאים ורקמות שונים.
סוג חדש של טיפול ב-RNA מופיע ברגע ההיסטורי
נכון ל-21 בדצמבר השנה, בתחום הטיפול ב-RNA, התקיימו 31 אירועי מימון בשלבים מוקדמים (ראה מתודולוגיה בסוף המאמר לפרטים), בהשתתפות 30 חברות מתקדמות (חברה אחת קיבלה מימון פעמיים), בסכום מימון כולל של 1.74 מיליארד דולר.ניתוח החברות הללו מראה שהמשקיעים אופטימיים יותר לגבי אותן חברות מתקדמות שצפויות לפתור אתגרים רבים של טיפול ב-RNA, על מנת לממש את הפוטנציאל של טיפול ב-RNA במלואו ולהועיל ליותר מטופלים.
וישנן חברות צומחות המפתחות סוגים חדשים לגמרי של תרופות RNA.בניגוד לאוליגונוקלאוטידים מסורתיים, RNAi או mRNA, הסוגים החדשים של מולקולות RNA שפותחו על ידי חברות אלו צפויות לפרוץ את צוואר הבקבוק של הטיפולים הקיימים.
RNA מעגלי הוא אחד הנקודות החמות בתעשייה.בהשוואה ל-mRNA ליניארי, טכנולוגיית ה-RNA המעגלי שפותחה על ידי חברה מתקדמת בשם Orna Therapeutics יכולה להימנע מזיהוי על ידי מערכת החיסון המולדת ואקסונוקלאזים, מה שלא רק מפחית משמעותית את האימונוגניות, אלא גם בעל יציבות גבוהה יותר.בנוסף, בהשוואה ל-RNA ליניארי, הקונפורמציה המקופלת של RNA מעגלית קטנה יותר, וניתן להטעין יותר RNA מעגלי באותו LNP, מה שמשפר את יעילות האספקה של טיפול ב-RNA.תכונות אלו יכולות לעזור לשפר את העוצמה והעמידות של תרופות RNA.
השנה השלימה החברה סבב מימון של 221 מיליון דולר של סדרה B, והגיעה גם למחקרשיתוף פעולה בפיתוח עם Merck של עד 3.5 מיליארד דולר.בנוסף, אורנה משתמשת גם ב-RNA מעגלי כדי ליצור ישירות טיפול CAR-T בבעלי חיים, והשלמת הוכחה שלמוּשָׂג.
בנוסף ל-RNA מעגלי, טכנולוגיית mRNA מגבירה עצמית (samRNAs) זכתה גם להעדפה על ידי משקיעים.טכנולוגיה זו מבוססת על מנגנון ההגברה העצמית של נגיפי RNA, שיכול לגרום לשכפול של רצפי samRNA בציטופלזמה, להאריך את קינטיקה של הביטוי של תרופות טיפוליות mRNA, ובכך להפחית את תדירות המתן.בהשוואה ל-mRNA ליניארי מסורתי, samRNA מסוגל לשמור על רמות ביטוי חלבון דומות במינונים נמוכים יותר של פי 10 בערך.השנה, RNAimmune, המתמקדת בפיתוח תחום זה, קיבלה מימון של 27 מיליון דולר מסדרה A.
גם לטכנולוגיית tRNA כדאי לצפות.הטיפול המבוסס על tRNA יכול "להתעלם" מקודון העצירה השגוי כאשר התא מייצר את החלבון, כך שהחלבון הרגיל באורך מלא מיוצר.מכיוון שיש הרבה פחות סוגים של קודונים לעצור מאשר מחלות קשורות, לטיפול ב-tRNA יש פוטנציאל לפתח טיפול יחיד שיכול לטפל במחלות רבות.השנה, hC Bioscience, המתמקדת בטיפול ב-tRNA, גייסה סך של 40 מיליון דולר במימון סדרה A.
Eפילוג
כמודל טיפול מתהווה, טיפול ב-RNA השיג התפתחות מהירה בשנים האחרונות, וטיפולים רבים אושרו.מההתפתחויות האחרונות בתעשייה ניתן לראות שטיפולי RNA חדשניים מרחיבים את מגוון המחלות שטיפולים כאלה יכולים לטפל בהם, מתגברים על צווארי בקבוק שונים באספקה ממוקדת, ומפתחים מולקולות RNA חדשות כדי להתגבר על מגבלות הטיפולים הקיימים מבחינת יעילות ועמידות.אתגרים מרובים.בעידן חדש זה של טיפול ב-RNA, חברות מתקדמות אלו עשויות להפוך למוקד התעשייה בשנים הקרובות.
מוצרים קשורים:
https://www.foreivd.com/cell-direct-rt-qpcr-kit-taqman-product/
https://www.foreivd.com/cell-direct-rt-qpcr-kit-direct-rt-qpcr-series/
זמן פרסום: 27 בדצמבר 2022