PCR (תגובת שרשרת פולימראז) היא אחת מטכנולוגיות הגברה של DNA במבחנה, עם היסטוריה של יותר מ-30 שנה.
טכנולוגיית PCR נוצרה על ידי קארי מוליס מ-Cetus, ארה"ב בשנת 1983. Mullis הגיש בקשה לפטנט PCR בשנת 1985 ופרסם את המאמר האקדמי הראשון של PCR על מדע באותה שנה.מוליס זכה בפרס נובל לכימיה בשנת 1993 על עבודתו.
עקרונות בסיסיים של PCR
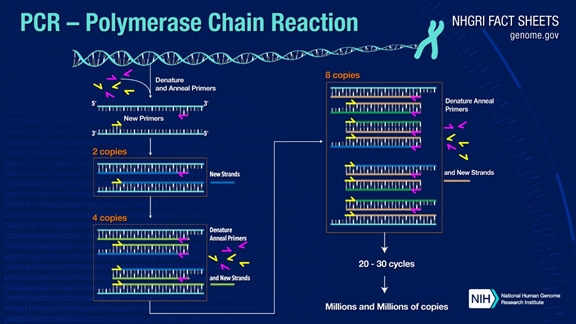
PCR יכול להגביר את קטעי ה-DNA של המטרה ביותר ממיליון פעמים.העיקרון נמצא תחת קטליזה של DNA פולימראז, תוך שימוש ב-DNA של גדיל אב כתבנית ובפריימר ספציפי כנקודת המוצא להארכה.הוא משוכפל במבחנה באמצעות שלבים כגון דנטורציה, חישול והרחבה.תהליך ה-DNA של גדיל הבת המשלים ל-DNA של תבנית גדיל האב.
תהליך ה-PCR הסטנדרטי מחולק לשלושה שלבים:
1. דנטורציה: השתמש בטמפרטורה גבוהה כדי להפריד גדילי DNA כפולים.קשר המימן בין גדילי DNA כפולים נשבר בטמפרטורה גבוהה (93-98℃).
2. חישול: לאחר הפרדת ה-DNA הדו-גדילי, הורידו את הטמפרטורה כך שהפריימר יוכל להיקשר ל-DNA החד-גדילי.
3. הרחבה: ה-DNA פולימראז מתחיל לסנתז גדילים משלימים לאורך גדילי ה-DNA מהפריימרים הקשורים כאשר הטמפרטורה יורדת.כאשר ההרחבה מסתיימת, מסתיים מחזור, ומספר שברי ה-DNA מוכפל
בהדדיות שלושת השלבים הללו 25-35 פעמים, מספר שברי ה-DNA יגדל באופן אקספוננציאלי.
כושר ההמצאה של PCR הוא שניתן לעצב פריימרים שונים עבור גני מטרה שונים, כך שניתן להגביר את שברי גן המטרה בפרק זמן קצר.
עד כה, ניתן לחלק את ה-PCR לשלוש קטגוריות, כלומר PCR רגיל, PCR כמותי פלואורסצנטי ו-PCR דיגיטלי.
הדור הראשון של PCR רגיל
השתמש במכשיר הגברה רגיל של PCR כדי להגביר את גן המטרה, ולאחר מכן השתמש באלקטרופורזה של ג'ל agarose כדי לזהות את המוצר, ניתן לבצע רק ניתוח איכותי.
החסרונות העיקריים של הדור הראשון של PCR:
1. נוטה להגברה לא ספציפית ולתוצאות חיוביות שגויות.
2. הגילוי אורך זמן רב והפעולה מסורבלת.
3. ניתן לבצע רק בדיקה איכותית
הדור השני של PCR בזמן אמת
PCR בזמן אמת, הידוע גם בשם qPCR, משתמש בבדיקות פלואורסצנטיות שיכולות להצביע על התקדמות מערכת התגובה, ומנטר את הצטברות המוצרים המוגברים באמצעות הצטברות אותות פלואורסצנטיים, ושופט את התוצאות באמצעות עקומת הקרינה.ניתן לכמת אותו בעזרת ערך Cq ועקומה סטנדרטית.
מכיוון שטכנולוגיית ה-qPCR מתבצעת במערכת סגורה, ההסתברות לזיהום מצטמצמת, וניתן לנטר את אות הקרינה לזיהוי כמותי, כך שהיא הרווחת ביותר בפרקטיקה הקלינית והפכה לטכנולוגיה הדומיננטית ב-PCR.
ניתן לחלק את החומרים הפלורסנטים המשמשים ב-PCR כמותי פלואורסצנטי בזמן אמת: בדיקה פלורסנטית TaqMan, משואות מולקולריות וצבע ניאון.
1) בדיקה פלורסנטית של TaqMan:
במהלך הגברה של PCR, מתווספת בדיקה פלורסנטית ספציפית תוך הוספת זוג פריימר.הבדיקה היא אוליגונוקלאוטיד, ושני הקצוות מסומנים בקבוצת פלואורסצנטי כתב וקבוצת ניאון מרווה.
כאשר הגשושית שלמה, האות הפלורסצנטי הנפלט על ידי קבוצת הכתבים נספג על ידי הקבוצה המכווה;במהלך הגברה של PCR, פעילות האקסונוקלאז 5'-3' של אנזים Taq מבקעת ומפרקת את הגשש, מה שהופך את קבוצת הדיווח הפלואורסצנטית והמרווה. קבוצת הפלורסנט מופרדת, כך שמערכת ניטור הקרינה יכולה לקבל את אות הקרינה, כלומר, בכל פעם שגדיל ה-DNA מצטבר, גדילת ה-DNA מצטברת פלואורסצנטית. אות cence מסונכרן לחלוטין עם היווצרות המוצר PCR.
2) צבע ניאון SYBR:
במערכת התגובה PCR, מוסיפים עודף של צבע ניאון SYBR.לאחר שצבע הפלורסנט SYBR משולב בצורה לא ספציפית ב-DNA הכפול, הוא פולט אות ניאון.מולקולת הצבע SYBR שאינה משולבת בשרשרת לא תפלוט שום אות פלואורסצנטי, ובכך תבטיח את האות הפלורסנטי העלייה במוצרי PCR מסונכרנת לחלוטין עם העלייה במוצרי PCR.SYBR נקשר רק ל-DNA דו-גדילי, כך שניתן להשתמש בעקומת ההיתוך כדי לקבוע אם תגובת ה-PCR היא ספציפית.
3) משואה מולקולרית:
זהו בדיקת אוליגונוקלאוטידים עם תווית כפולה של גזע היוצר מבנה סיכת ראש של כ-8 בסיסים בקצוות 5 ו-3.רצפי חומצות הגרעין בשני הקצוות מזווגים באופן משלים, מה שגורם לקבוצת הפלורסנט ולקבוצת המרווה להיות הדוקים.סגור, לא תיווצר פלואורסצנטי.
לאחר יצירת תוצר ה-PCR, במהלך תהליך החישול, החלק האמצעי של המשואה המולקולרית מזווג לרצף DNA ספציפי, והגן הפלורסנטי מופרד מהגן המרווה כדי לייצר פלואורסצנטיות.
החסרונות העיקריים של הדור השני של PCR:
הרגישות עדיין חסרה, והזיהוי של דגימות בעותק נמוך אינו מדויק.
יש השפעה של ערך הרקע, והתוצאה רגישה להפרעות.
כאשר ישנם מעכבי PCR במערכת התגובה, תוצאות הגילוי חשופות להפרעות.
דור שלישי של PCR דיגיטלי
PCR דיגיטלי (DigitalPCR, dPCR, Dig-PCR) מחשב את מספר ההעתקים של רצף היעד באמצעות זיהוי נקודת קצה, ויכול לבצע זיהוי כמותי מוחלט ללא שימוש בבקרות פנימיות ובעקומות סטנדרטיות.
PCR דיגיטלי משתמש בזיהוי נקודת קצה ואינו תלוי בערך ה-Ct (סף מחזור), כך שתגובת ה-PCR הדיגיטלית מושפעת פחות מיעילות ההגברה, והסבילות למעכבי תגובת PCR משתפרת, עם דיוק ושחזור גבוהים.
בשל המאפיינים של רגישות גבוהה ודיוק גבוה, הוא אינו מתערב בקלות על ידי מעכבי תגובת PCR, והוא יכול להשיג כימות מוחלט אמיתי ללא מוצרים סטנדרטיים, שהפך למוקד מחקר ויישום.
על פי הצורות השונות של יחידת התגובה, ניתן לחלק אותה לשלושה סוגים עיקריים: מערכות מיקרופלואידיות, שבבים וטיפות.
1) PCR דיגיטלי מיקרופלואידי, mdPCR:
בהתבסס על הטכנולוגיה המיקרופלואידית, תבנית ה-DNA מופרדת.הטכנולוגיה המיקרופלואידית יכולה לממש את שדרוג הננו של המדגם או יצירת טיפות קטנות יותר, אך הטיפות זקוקות לשיטת ספיחה מיוחדת ולאחר מכן בשילוב עם מערכת התגובה PCR.mdPCR אומצה בהדרגה על ידי שיטות אחרות להחליף.
2) PCR דיגיטלי מבוסס טיפות, ddPCR:
השתמש בטכנולוגיית ייצור טיפות מים בשמן כדי לעבד את הדגימה לטיפות, ולחלק את מערכת התגובה המכילה מולקולות חומצת גרעין לאלפי טיפות בקנה מידה ננוקל, שכל אחת מהן אינה מכילה את מולקולת המטרה של חומצת הגרעין שתתגלה, או מכילה אחת לכמה מולקולות יעד של חומצת גרעין לבדיקה.
3) PCR דיגיטלי מבוסס שבב, cdPCR:
השתמש בטכנולוגיית מסלול הנוזל המשולב כדי לחרוט מיקרו-צינורות ומיקרו-חללים רבים על פרוסות סיליקון או זכוכית קוורץ, ולשלוט בזרימת התמיסה דרך שסתומי בקרה שונים, ולחלק את נוזל הדגימה לננומטרים באותו גודל לתוך בארות התגובה לתגובת PCR דיגיטלית כדי להשיג כימות מוחלט.
החסרונות העיקריים של הדור השלישי של PCR:
הציוד והריאגנטים יקרים.
דרישות איכות התבנית גבוהות.אם כמות התבנית עולה על כמות המיקרו-מערכת, אי אפשר יהיה לכמת, ואם היא קטנה מדי, דיוק הכימות יקטן.
חיוביות כוזבות יכולות להיווצר גם כאשר יש הגברה לא ספציפית.
זמן פרסום: 30 ביולי 2021