Ⅰ. הגבר את הרגישות של מערכת התגובה:
1. הפרד RNA באיכות גבוהה:
סינתזת cDNA מוצלחת מגיעה מ-RNA באיכות גבוהה.RNA באיכות גבוהה אמור להבטיח לפחות זמן ארוך יותר ואינו מכיל מעכבים שאינם מכילים אנזימים מתעדים, כגון EDTA או SDS.איכות ה-RNA קובעת את הערך המקסימלי של מידע הרצף שאתה יכול לתמלל ל-cDNA.שיטת טיהור ה-RNA הכללית היא שיטת שלב של שימוש באיזווציאנאט/אצידופנול.על מנת למנוע את זיהום ה-RNase, ה-RNA המופרד מדגימה עשירה ב-RNase (כגון לבלב) מצריך אחסון של פורמלדהיד כדי לחסוך ב-RNA באיכות גבוהה, וזה עוד יותר מתאים לאחסון לטווח ארוך.ה-RNA שהופק מכבד החולדות התפרק בעצם לאחר שבוע אחד של אחסון במים, בעוד שה-RNA שהופק מטחול החולדות נשאר יציב לאחר שלוש שנות אחסון במים.בנוסף, תמלילים גדולים מ-4kb רגישים יותר לפירוק RNase עקבות מאשר תמלילים קטנים.על מנת להגביר את היציבות של דגימת ה-RNA האחסון, ניתן להמיס את ה-RNA במתאלמין של יון, והוא מאוחסן -70 מעלות צלזיוס.לתילייד המשמש להצלת RNA אסור להכיל חפץ שונה שמפרק RNA.RNA, שמקורו בלבלב, יכול להישמר במתלמין למשך שנה אחת לפחות.כאשר אתה מוכן להשתמש ב-RNA, אתה יכול להשתמש בשיטות הבאות כדי לזרז RNA: הוסף NaCl ל-0.2 מ' ופי 4 מנפח האתנול, הנח את טמפרטורת החדר למשך 3-5 דקות, ו-10,000 × גרם צנטריפוגלי למשך 5 דקות.
2. השתמש ב-reverse transcriptase ללא פעילות RNaseH (RNaseH-):
מעכבי RNase מתווספים לעתים קרובות לתגובות שעתוק הפוכה כדי להגדיל את האורך והתפוקה של סינתזת cDNA.מעכב RNase מתווסף בתגובת סינתזת השרשרת הראשונה בנוכחות מאגרים וחומרים מפחיתים כגון DTT מכיוון שתהליך סינתזת טרום-cDNA מעכב את המעכב, ובכך משחרר RNases קשורים שמפרקים RNA.מעכב חלבון RNase רק מונע את הפירוק של RNA על ידי RNase A, B, C, ואינו מונע RNases על העור, ולכן יש להיזהר שלא להכניס RNases מהאצבעות למרות השימוש במעכבים אלו.
Transcriptase הפוך מזרז את ההמרה של RNA ל-cDNA.גם ל-M-MLV וגם ל-AMV יש פעילות RNaseH אנדוגנית בנוסף לפעילות הפולימראז שלהם.פעילות RNaseH מתחרה עם פעילות פולימראז על גדילים הטרוזיגוטיים הנוצרים בין תבניות RNA ו-DNA primers או גדילי הארכה של cDNA, ומפרקת RNA: גדילי RNA במתחמי DNA.תבניות RNA שפורקו על ידי פעילות RNaseH אינן יכולות לשמש עוד כמצעים יעילים לסינתזת cDNA, מה שמפחית את התפוקה והאורך של סינתזת cDNA.לפיכך, ביטול או הפחתה מאוד של פעילות RNaseH של תעתיק הפוך יהיה בעל תועלת רבה.
SuperScriptⅡ transcriptase לאחור, MMLV transcriptase לאחור של RNaseH- ו-thermoScript transcriptase לאחור, AMV של RNaseH- הניב יותר cDNA באורך מלא מאשר MMLV ו-AMV.רגישות RT-PCR מושפעת מכמות ה-cDNA המסונתז.ThermoScript הרבה יותר רגיש מ-AMV.הגודל של מוצרי RT-PCR מוגבל על ידי היכולת של תעתיק הפוך לסנתז cDNA, במיוחד בעת שיבוט Cdnas גדולים יותר.בהשוואה ל-MMLV, SuperScripⅡ הגדיל משמעותית את התשואה של מוצרי RT-PCR ארוכים.התעתיק ההפוך של RNaseH- מגביר גם את היציבות התרמית, כך שניתן לבצע את התגובה בטמפרטורות גבוהות מהרגיל של 37-42℃.בתנאי הסינתזה המוצעים, נעשה שימוש בפריימרים של אוליגו(dT) ו-10μCi [alpha-p]dCTP.סך הייצור של השרשרת הראשונה חושב בשיטת המשקעים TCA.cDNA באורך מלא נותח באמצעות הסרת רצועות ממוינות בגודל וספירה בג'ל אגרוז אלקליין.
3. הגדל את טמפרטורת שימור החום של תעתיק הפוך:
טמפרטורת החזקה גבוהה יותר עוזרת לפתוח את המבנה המשני של RNA ולהגדיל את תפוקת התגובה.עבור רוב תבניות ה-RNA, החזקת ה-RNA והפריימר ב-65 מעלות צלזיוס ללא חיץ או מלח ולאחר מכן קירורם במהירות על קרח מבטלת את רוב המבנים המשניים ומאפשרת לפריימרים להיקשר.עם זאת, לחלק מהתבניות עדיין יש מבנה משני, גם לאחר דנטורציה תרמית.ניתן לבצע הגברה של תבניות קשות אלו באמצעות ThermoScript הפוך תעתיק ועל ידי הצבת תגובת התעתיק ההפוך בטמפרטורות גבוהות יותר כדי לשפר את ההגברה.טמפרטורות החזקה גבוהות יותר יכולות גם להגביר את הספציפיות, במיוחד כאשר סינתזת cDNA מתבצעת באמצעות פריימרים ספציפיים לגנים (GSPS) (ראה פרק 3).אם אתה משתמש ב-GSP, ודא שערך ה-Tm של הפריימר זהה לטמפרטורת ההחזקה הצפויה.אין להשתמש ב-oligo(dT) ובפריימרים אקראיים מעל 60℃.יש להחזיק פריימרים אקראיים ב-25℃ למשך 10 דקות לפני העלאה ל-60℃.בנוסף לשימוש בטמפרטורות גבוהות יותר של שעתוק הפוך, ניתן לשפר את הספציפיות על ידי העברה ישירה של תערובת ה-RNA/פריימר מטמפרטורת הדנטורציה של 65℃ לטמפרטורת החזקת השעתוק האחורי והוספת תערובת תגובה מחוממת 2× (סינתזה תרמית של cDNA).גישה זו עוזרת למנוע את זיווג הבסיסים הבין-מולקולרי המתרחש בטמפרטורות נמוכות יותר.שימוש במכשיר PCR מפשט את מתגי הטמפרטורה הרבים הנדרשים ל-RT-PCR.
Tth פולימראז מיוצב בחום פועל כפולימראז DNA בנוכחות Mg2+ ו-RNA פולימראז בנוכחות Mn2+.זה יכול להחזיק חום של עד 65 ℃.עם זאת, הנוכחות של Mn2+ במהלך PCR מפחיתה את הנאמנות, מה שהופך את הפולימראז של Tth לפחות מתאים להגברה דיוק גבוהה, כגון שיבוט cDNA.בנוסף, Tth פחות יעיל בשעתוק הפוך, מה שמפחית את הרגישות, ומכיוון שאנזים בודד יכול לבצע שעתוק הפוך ו-PCR, לא ניתן להשתמש בתגובות בקרה ללא שעתוק הפוך כדי להבחין בין תוצרים מוגברים של cDNA מאלה של DNA גנומי מזוהם.
4. תוסף המקדם תעתיק הפוך:
תוספת של תוספים, כולל גליצרין ו-DMSO, לתגובת סינתזת השרשרת הראשונה יכולה להפחית את היציבות של החומצה הכפולה של חומצת הגרעין ולשחרר את המבנה המשני של ה-RNA.ניתן להוסיף עד 20% גליצרין או 10% DMSO מבלי להשפיע על הפעילות של SuperScriptⅡ או MMLV.AMV יכול גם לסבול עד 20% גליצרול מבלי להפחית את הפעילות.כדי למקסם את הרגישות של RT-PCR בתגובת שעתוק הפוכה SuperScriptⅡ, ניתן להוסיף 10% גליצרול ולבודד ב-45℃.אם מוסיפים ל-PCR 1/10 מהתוצר של רטרו-תעתיק-תגובה, ריכוז הגליצרול בתגובת ההגברה הוא 0.4%, מה שלא מספיק לעיכוב PCR.
5. עיבוד RNaseH:
ניתן לשפר את הרגישות על ידי טיפול בתגובות סינתזה של cDNA עם RNaseH לפני PCR.עבור תבניות מסוימות, נהוג לחשוב שה-RNA בתגובת סינתזת cDNA מונע את הקישור של מוצרים מוגברים, ובמקרה זה הטיפול ב-RNaseH יכול להגביר את הרגישות.בדרך כלל, טיפול ב-RNaseH נדרש להגברה של תבנית יעד cDNA ארוכה יחסית באורך מלא, כגון tuberous scherosisⅡ עם עותק נמוך.עבור תבנית קשה זו, RNaseH שיפר את האות שנוצר על ידי cDNA מסונתז על ידי SuperScriptⅡ או AMV.עבור רוב תגובות RT-PCR, הטיפול ב-RNaseH הוא אופציונלי מכיוון ששלב הדנטורציה של PCR מבודד 95℃ מבצע בדרך כלל הידרוליזה של ה-RNA מהקומפלקס של RNA: DNA.
6. שיטות משופרות לאיתור כמויות קטנות של RNA:
RT-PCR הוא מאתגר במיוחד כאשר רק כמויות קטנות של RNA זמינות.הוספה של גליקוגן כנשא במהלך הפרדת RNA עוזרת להגדיל את התשואה של דגימות קטנות.ניתן להוסיף גליקוגן נטול RNase במקביל ל-Trizol.הגליקוגן מסיס במים ויכול להישאר בשלב המים עם RNA כדי לסייע במשקעים הבאים.הריכוז המומלץ של גליקוגן נטול RNase הוא 250μg/ml עבור דגימות של פחות מ-50mg של רקמה או 106 תאים בתרבית.
הוספה של BSA עם אצטילציה לתגובות שעתוק הפוכה באמצעות SuperScriptⅡ יכולה להגביר את הרגישות, ועבור כמויות קטנות של RNA, הפחתת כמות SuperScriptⅡ והוספת 40 יחידות של מעכב נוקלאז RNAseOut יכולה לשפר את רמת הזיהוי.אם נעשה שימוש בגליקוגן בהפרדת RNA, הוספה של מעכבי BSA או RNase להיפוך תגובות שעתוק באמצעות SuperScriptⅡ עדיין מומלצת.
Ⅱ. הגדל את הספציפיות של RT-PCR
1. סינתזת cNDA:
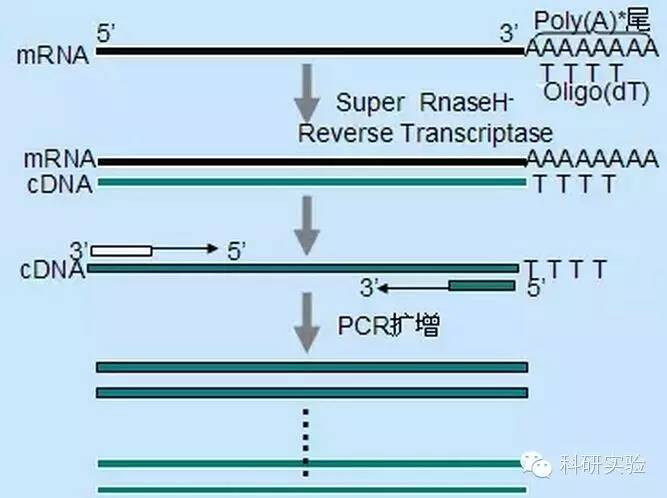
ניתן להשתמש בשלוש שיטות שונות כדי ליזום סינתזת cDNA של גדיל ראשון, והספציפיות היחסית של כל שיטה משפיעה על כמות וסוג ה-cDNA המסונתז.
שיטת פריימר אקראית היא הפחות ספציפית מבין שלוש השיטות.פריימרים מסובכים במספר אתרים לאורך התמלול כדי לייצר cDNA קצר באורך חלקי.שיטה זו משמשת לעתים קרובות להשגת רצפים סופניים של 5′ ו-cDNA מתבניות RNA עם אזורים מבניים משניים או עם אתרים מסתיימים שלא ניתן לשכפל את ה-Reverse transcriptase.כדי להשיג את ה-cDNA הארוך ביותר, היחס בין פריימרים ל-RNA בכל דגימת RNA צריך להיקבע באופן אמפירי.הריכוז הראשוני של פריימרים אקראיים נע בין 50 ל-250ng למערכת תגובה של 20μl.מכיוון שה-cDNA המסונתז מ-RNA הכולל באמצעות פריימרים אקראיים הוא בעיקר RNA ריבוזמלי, פולי(A)+RNA נבחר בדרך כלל כתבנית.
התחלת Oligo(dT) ספציפית יותר מפריימרים אקראיים.זה הכלאה עם זנב הפולי(A) שנמצא בקצה 3′ של mRNA ברוב התאים האוקריוטיים.מכיוון שפולי(A)+RNA הוא בערך 1% עד 2% מסך ה-RNA, הכמות והמורכבות של cDNA נמוכה בהרבה מאשר אם נעשה שימוש בפריימרים אקראיים.בגלל הספציפיות הגבוהה שלו, אוליגו(dT) בדרך כלל אינו דורש אופטימיזציה ליחס RNA לפריימר ולבחירת poly(A)+.מומלץ להשתמש ב-0.5μg oligo(dT) לכל מערכת תגובה של 20μl.oligo(dT)12-18 מתאים לרוב RT-PCR.מערכת ThermoScript RT-PCR מספקת oligo(dT)20 בגלל היציבות התרמית הטובה שלה ומתאימה לטמפרטורות החזקה גבוהות יותר.
פריימרים ספציפיים לגנים (GSP) הם הפריימרים הספציפיים הטובים ביותר לשלב השעתוק ההפוך.GSP הוא אוליגונוקלאוזיד אנטי-סנס שיכול להכליא באופן ספציפי עם רצפי יעד של RNA, במקום לחשל את כל ה-RNA כמו פריימרים אקראיים או אוליגו(dT).הכללים המשמשים לעיצוב פריימרים של PCR חלים גם על עיצוב תגובת שעתוק הפוכה GSP.GSP יכול להיות זהה לרצף של פריימר ההגברה המחובר בסוף ה-mRNA3′, או ש-GSP יכול להיות מתוכנן כך שיהיה חישול במורד הזרם עם פריימר ההגברה ההפוכה.עבור כמה אובייקטים מוגברים, יש צורך לעצב יותר מפריימר אנטי-סנס אחד ל-RT-PCR מוצלח מכיוון שהמבנה המשני של RNA היעד עשוי למנוע מהפריימר להיקשר.מומלץ להשתמש ב-1pmol antisense GSP במערכת תגובת סינתזת השרשרת הראשונה של 20μl.
2. הגדל את טמפרטורת שימור החום של תעתיק הפוך:
על מנת לנצל את מלוא הספציפיות של GSP, יש להשתמש ב-reverse transcriptase עם יציבות תרמית גבוהה.ניתן לבודד טראנסקריפטאז הפוך יציב בחום בטמפרטורות גבוהות יותר כדי להגביר את קשיחות התגובה.לדוגמה, אם GSP מחולל ב-55°C, אזי הספציפיות של GSP לא מנוצלת במלואה אם שעתוק הפוך מבוצע ב-37°C עם קפדנות נמוכה באמצעות AMV או M-MLV.עם זאת, SuperScripⅡ ו-ThermoScript יכולים להגיב בטמפרטורה של 50℃ ומעלה, מה שמבטל מוצרים לא ספציפיים המיוצרים בטמפרטורות נמוכות יותר.לספציפיות מירבית, ניתן להעביר את תערובת ה-RNA/פריימר ישירות מטמפרטורת הדנטורציה של 65℃ לטמפרטורת החזקת התעתיק ההפוך עם תוספת של תערובת תגובה מחוממת 2x (התחלה תרמית של סינתזת cDNA).זה עוזר למנוע זיווג בסיסי בין מולקולות בטמפרטורות נמוכות.שימוש במכשיר PCR מפשט את מעברי הטמפרטורה הרבים הנדרשים ל-RT-PCR.
3. הפחת זיהום DNA גנומי:
קושי פוטנציאלי אחד עם RT-PCR הוא ש-RNA מזהם DNA גנומי.השימוש בשיטות הפרדת RNA טובות יותר, כגון Trizol Reagent, מפחית זיהום DNA גנומי בתכשירי RNA.כדי להימנע ממוצרים המיוצרים מ-DNA גנומי, ניתן לטפל ב-RNA עם DnasⅠ בדרגת הגברה כדי להסיר DNA מזוהם לפני שעתוק הפוך.הדגימות נשמרו בטמפרטורה של 65℃ ב-2.0mM EDTA למשך 10 דקות כדי להפסיק את עיכול DNaseⅠ.EDTA משלט יוני מגנזיום כדי למנוע הידרוליזה של RNA תלוי יוני מגנזיום המתרחשת בטמפרטורות גבוהות.
על מנת להפריד cDNA מוגבר מתוצר הגברה של DNA הגנום, ניתן לעצב פריימרים המתלכדים בנפרד עם האקסון המופרד.מוצרי PCR שמקורם ב-cDNA יהיו קצרים יותר מאלה שמקורם ב-DNA גנומי מזוהם.ניסוי מבוקר ללא שעתוק הפוך מבוצע גם על כל תבנית RNA כדי לקבוע אם קטע נתון הוא מ-DNA גנומי או cDNA.תוצרי PCR המתקבלים בהיעדר שעתוק הפוך נגזרים מהגנום.
מוצרים קשורים
-ערכת השלב האחד מאפשרת לבצע שעתוק הפוך ו-PCR באותו צינור.זה רק צריך להוסיף RNA תבנית, פריימרים ספציפיים של PCR ו-RNase-Free ddH2O.
-ניתן לבצע ניתוח כמותי של RNA בזמן אמת במהירות ובדייקנות.
-הערכה משתמשת במגיב ייחודי לשעתוק הפוך של Foregene וב-Foregene HotStar Taq DNA Polymerase בשילוב עם מערכת תגובה ייחודית כדי לשפר ביעילות את יעילות ההגברה והספציפיות של התגובה.
-מערכת התגובה האופטימלית גורמת לתגובה רגישות זיהוי גבוהה יותר, יציבות תרמית חזקה יותר וסובלנות טובה יותר.
RT Easy II (עם GDNase) מאסטר Premix עבור סינתזת CDNA ברצף ראשון עבור PCR בזמן אמת עם GDNase
-יכולת יעילה להסרת gDNA, שיכולה להסיר gDNA בתבנית תוך 2 דקות.
-מערכת שעתוק לאחור יעילה, לוקח רק 15 דקות להשלים את הסינתזה של cDNA הגדיל הראשון.
-תבניות מורכבות: ניתן גם להפוך תבניות עם תוכן GC גבוה ומבנה משני מורכב ביעילות גבוהה.
-מערכת שעתוק לאחור ברגישות גבוהה, תבניות ברמת pg יכולות גם לקבל cDNA באיכות גבוהה.
-למערכת השעתוק ההפוך יש יציבות תרמית גבוהה, טמפרטורת התגובה האופטימלית היא 42 ℃, ועדיין יש לה ביצועי שעתוק הפוך טובים ב 50 ℃.
זמן פרסום: מרץ-07-2023